Внутренний стволовой продукт: что мешает взлету медицинских клеточных технологий в России
01.08.2018
Обращение биомедицинских клеточных продуктов (БМКП), фактически происходящее в России более 20 лет, до сих пор не получило адекватного нормативного обеспечения. Долго разрабатывавшийся и наконец принятый 23 июня 2016 года федеральный закон №180-ФЗ «О биомедицинских клеточных продуктах» получился, как это часто бывает, документом рамочным и понятийно ущербным. Для легитимизации сегмента и формирования полноценного рынка БМКП, по оценкам участников отрасли, понадобятся еще как минимум 15 правовых актов разного статуса. В то же время все нынешние попытки регуляторов с помощью действующего 180-ФЗ очистить индустрию здравоохранения от несовершенных и небезопасных клеточных технологий, методик и продуктов уже обернулись коллапсом – на этап доклинических исследований отброшены более 20 разработок, вполне готовых, по оценкам их авторов, к практическому применению. Vademecum проследил историю возникновения клеточной ниши, замерил активность действующих в этой инновационной сфере операторов и оценил перспективу рынка БМКП.
С особенным нетерпением перспективная клеточная отрасль ждет правил лицензирования производства БМКП. Свет на судьбу этого документа пролил, выступая в начале июля на онкофоруме «Белые ночи», директор Департамента науки, инновационного развития и управления медико‑биологическими рисками здоровью Минздрава РФ Игорь Коробко: соответствующий законопроект прошел в Госдуме первое чтение, готов ко второму и, как ожидается, уже в нынешнем году будет принят.
В проекте этого документа, так же как и в рамочном 180‑ФЗ, БМКП определяются как «комплекс, состоящий из клеточной линии (или линий) и вспомогательных веществ», в том числе с «прошедшими госрегистрацию» препаратами и медизделиями. По сути, БМКП – это результат использования стволовых клеток, способных к самообновлению, делению и превращению в клетки различных органов и тканей.
В этом качестве БМКП способны выступать одним из основных инструментов такого перспективного и капиталоемкого направления, как регенеративная медицина. Объем мирового «регенеративного» рынка, по оценкам ResearchAndMarkets, к 2025 году вырастет с нынешних $17,03 млрд до $50,6 млрд. Для сравнения – глобальный рынок офтальмологических медизделий (а это контактные и очковые линзы, профильное диагностическое и хирургическое медоборудование), по оценкам аналитиков, к тому же 2025 году преодолеет планку в $71,9 млрд.
Но помимо того, что БМКП могут эффективно использоваться для восстановления кожи и других пораженных тканей, клеточные технологии находят все большее применение в лечении различных онкологических заболеваний, процедурах омоложения и многих других медицинских сферах.
При общей невнятности нормативного сопровождения отечественной клеточной отрасли действующим законодательством однозначно жестко установлен один запрет – на использование эмбриональных стволовых клеток. И хотя пресловутый ФЗ‑180 вступил в силу только 1 января 2017 года, а остальные жизненно необходимые инновационному сегменту правовые акты зависли в стадии разработки и утверждения, клеточные технологии успели просочиться в российскую клиническую практику.
РЕГЕНЕРАЦИОННЫЙ ТОЛК
Впервые термин «порождающая клетка», в нынешнем понимании – «стволовая клетка», в российскую науку в 1909 году ввел гистолог Александр Максимов. Он изучал процесс кроветворения и, в частности, роль лимфоцитов в эмбриональном развитии и жизни млекопитающих. Выводы Максимова гораздо позже – в 1960‑е – подтвердили американские ученые Джеймс Тилл и Эрнест Маккалох, доказавшие наличие стволовых клеток в костном мозге и тем самым фундаментально обосновавшие трансплантацию костного мозга.

Гистолог Александр Максимов в 1909 году на конференции в Берлине представил доклад, в котором в первые применил термин «порождающая клетка»
Фото: med-history.livejournal.com
Параллельно тему развивали советские ученые из НИИ эпидемиологии и микробиологии им. Н.Ф. Гамалеи Александр Фриденштейн и Иосиф Чертков. Первые экспериментальные трансплантации пациентам их собственных клеток стали проводиться в СССР в 70‑е. В одном из интервью академик Геннадий Сухих вспоминал, что в 1980 году на сессии Академии наук Владимир Энгельгард представил доклад «Клетки на службе медицины», предсказав, что в будущем клеточные технологии станут ведущим терапевтическим методом: «Но, увы, невнимание и отсутствие ассигнований не дали идее осуществиться в должном виде».
Целенаправленная работа по изучению и внедрению клеточных методик велась главным образом по линии Министерства обороны. «В 1986 году в Америке начался бум стволовых клеток, настоящая золотая лихорадка. Конечно, эта информация доходила и до нас. После Военно‑медицинской академии я приехал в Москву, к профессору Сухих. Он как раз занимался этим направлением и предложил мне поучаствовать, – рассказывает гендиректор клиники «НейроВита» Андрей Брюховецкий. – В этом начинании нас поддержало и Минобороны, нужно было что‑то делать с ранеными на войне в Афганистане. Так что основная цель была – лечение боевых травм. Этим я и занялся на базе института Шумакова. Экспериментировали на животных – приходилось стрелять в собак, чтобы затем восстанавливать травмы спинного мозга с помощью стволовых клеток».
К исполнению спецзаказа Минобороны был привлечен и Институт биологии развития (ИБР) им. Н.К. Кольцова РАН. «Живой эквивалент кожи с клетками дермы и эпидермиса ученые нашего института разработали еще в 1986 году. Тогда было хорошо известно о подобных разработках в других странах и успехах в их применении», – рассказал представитель ИБР.
В 2000‑е научно‑практические изыскания уже по собственной инициативе и за свой счет стали проводить и другие научно‑клинические центры. В санкт‑петербургском НИИ им. Н.Н. Петрова, например, начали работать над противоопухолевой дендритно‑клеточной вакциной, а в НМХЦ им. Н.И. Пирогова появилась целая Клиника гематологии и клеточной терапии им. А.А. Максимова. Клинические исследования продолжались и в Шумаковском центре, и в Научном центре материнства и детства.
Здесь следует оговориться: к тому времени, когда терапия стволовыми клетками начала внедряться в клиническую практику, адепты методики разделились на два лагеря – выступавших за и против использования клеток эмбрионов.
В стане «либералов» оказался, например, Геннадий Сухих, на имя которого в 2000 году был даже зарегистрирован патент «Способ приготовления клеточного трансплантата из фетальных тканей» для лечения «широкого круга заболеваний». «Консерваторы» же, в числе которых был директор ИБР РАН, в прошлом глава Департамента инновационного развития и научного проектирования Минздрава РФ Андрей Васильев, опасались «коммерциализации женской репродуктивной сферы» и принципиально настаивали на неэтичности использования такого источника стволовых клеток, как плод. Несмотря на многочисленные выступления академика Сухих на центральном ТВ и в прессе, позиция Минздравсоцразвития оставалась жесткой – использовать можно собственные клетки пациента и донорские, а также те, что берутся из пуповинной крови, плаценты и околоплодных вод.
Впрочем, вплоть до 2007 года «эмбриональное» противостояние так и оставалось всего лишь полемикой, поскольку получение и обращение клеточных продуктов государством практически не регулировались. Пока Минздравсоцразвития не утвердило регламент выдачи разрешений на новые медицинские технологии. Легитимировать инновации было поручено Росздравнадзору. Тогда у авторов всевозможных, в том числе клеточных, методик впервые появилась возможность хоть как‑то узаконить применение своих разработок в клинической практике.
Документов, разрешающих в основном заготовку, хранение, тестирование, культивирование стволовых клеток, Росздравнадзор выписал немного. Всего, по данным Научного центра экспертизы средств медицинского применения (НЦЭСМП) Минздрава, регулятор раздал порядка 16 таких разрешений. Среди держателей, например, оказались Институт стволовых клеток человека (ИСКЧ), компания «Реметэкс», НИИ онкологии им. Н.Н. Петрова, Медицинский радиологический научный центр в Обнинске и ряд других организаций. Однако когда в 2011 году был принят базовый отраслевой закон №323‑ФЗ «Об основах охраны здоровья граждан», в котором понятие «медицинская технология» почему‑то отсутствовало, формат разрешений Росздравнадзора лишился нормативной силы, а клеточные продукты и методики вновь выпали из правового поля.
«Нередко применялись непроверенные продукты и технологии, хорошо, если они оказывались просто пустышками и не наносили вреда здоровью доверчивых пациентов. Деятельность подобных недобросовестных медицинских предпринимателей нанесла огромный репутационный урон использованию клеточных технологий, – полагают специалисты Института научной цитологии РАН. – Поэтому было просто необходимо ввести государственное регулирование этого рынка».
Представители профсообщества неоднократно пытались вывести дискуссию о законодательном обеспечении сегмента на правительственный уровень. По словам заведующего лабораторией генетики стволовых клеток Медико‑генетического научного центра Дмитрия Гольдштейна, еще в 2007 году они вместе с академиком Николаем Бочковым обращались к регуляторам с предложениями о создании тематической нормативной базы. На отсутствие правовых актов «в области стволовых клеток и биомедицины» обращал тогда внимание и вице‑премьер Сергей Иванов, возглавлявший правительственную комиссию по высоким технологиям и инновациям.
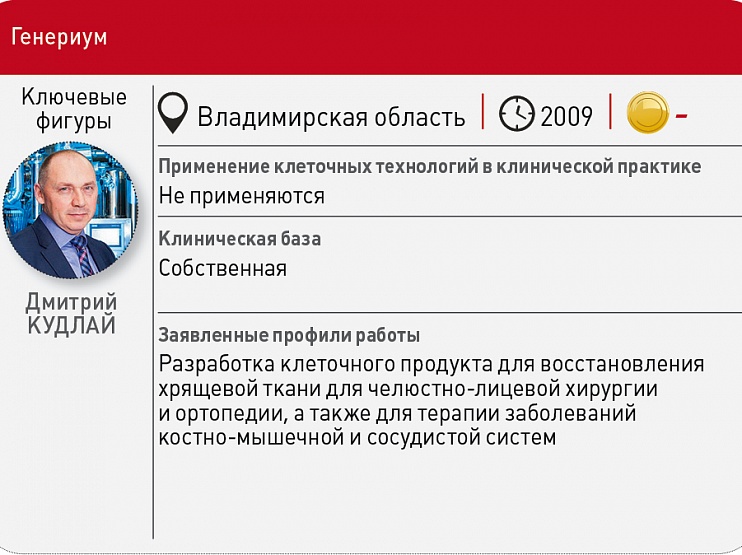
В итоге при Минздравсоцразвития все‑таки появилась профильная рабочая группа. «У нас закон этот готов. Он дважды вносился в правительство, прошел два полных цикла обсуждения и доработки. Это непростой закон в связи с тем, что многие процессы у нас вообще не были урегулированы, экспертное сообщество не приучено к жесткому следованию определенным регламентам», – говорила вскоре после своего назначения в 2012 году министром здравоохранения РФ Вероника Скворцова. Понадеявшись на то, что в клеточном секторе индустрии вот‑вот будет наведен порядок, профильную тематику принялись осваивать фармпроизводители. Например, «Фармстандарт» Виктора Харитонина в 2013 году зарегистрировал компанию «Селлтера Фарм», которая должна была выпускать персонализированные клеточные препараты для восстановления суставной хрящевой ткани (сейчас этот проект курирует «Генериум»). На совместную разработку компании «Биннофарм» и МГУ по созданию «живого эквивалента кожи» Минобрнауки даже выделило грант, правда, дальнейшую судьбу этого начинания Vademecum отследить не удалось.
В той же связи можно вспомнить стартап новосибирского ООО «АваксисБио»: компания биолога Амира Максютова провела доклинические испытания дендритно‑клеточной вакцины против рака молочной железы и собиралась получить венчурное финансирование «клиники», но в 2016 году, так и не дождавшись вступления в силу 180‑ФЗ, прекратила свое существование.
НЕМНОГО КЛЕТОЧНЫЕ
Впрочем, единственный действующий в сфере медицинских клеточных технологий законодательный акт не столько помогает, сколько тормозит их развитие и внедрение в клиническую практику. «Клеточная линия в законе определена как «стандартизованная популяция клеток одного типа с воспроизводимым клеточным составом», и хотя это определение является ключевым, его трактовка может быть различной, – говорит Дмитрий Гольдштейн. – Из-за чего разработчики, эксперты, инвесторы могут разойтись в оценке того, основан какой-либо продукт на клетках одного типа или нет. Эта законодательная невнятность может привести к возникновению дополнительных барьеров в допуске БМКП на рынок». При этом оценка эффективности и безопасности БМКП, говорят эксперты, оказывается строже, чем для лекарственных препаратов, что делает разработку клеточных продуктов более дорогой, а сам сектор – инвестиционно менее привлекательным.
За полтора года, что действует 180‑ФЗ, Минздрав принял целый пакет разнообразных сопутствующих документов, а Росздравнадзор открыл специальный раздел на своем сайте, но климат в клеточном сегменте это никак не улучшило. Например, согласно «дорожной карте» по развитию биотехнологий и генной инженерии, до 2020 года в России должны появиться 50 организаций, аккредитованных для проведения КИ клеточных продуктов, однако пока нет ни одной. Нигде не описан и порядок ввоза БМКП из‑за рубежа. А в законе «О лицензировании отдельных видов деятельности» отсутствует ключевое для клеточного сегмента понятие «биобанкирование». Поэтому, отмечает гендиректор «Генериума» Дмитрий Кудлай, в стране нет ни одной полностью легитимной организации, которая могла бы в соответствии с 180‑ФЗ обеспечивать производителей БМКП исходным сырьем.
Еще один острейший для сегмента вопрос – можно ли сегодня использовать клеточные технологии, опираясь на полученные некогда операторами разрешения Росздравнадзора? Некоторые участники рынка утверждают, что такая возможность действующим законом обнулена. А значит, всем без исключения операторам придется вновь проходить весь цикл разрешительных процедур – доклинические и клинические исследования, лицензирование производства, регистрацию. В Минздраве о той же проблеме рассуждают весьма расплывчато: «Если продукт, создаваемый в результате реализации технологии, соответствует определению БМКП, то он подпадает под действие 180‑ФЗ и подлежит государственной регистрации».
В общей сложности эксперты НЦСЭМП обнаружили в базе ClinicalTrials.gov 18 клеточных разработок, проходящих клинические испытания, но только для четырех из них КИ отмечены как завершенные, да и в практику эти продукты пока не внедрены. Мониторинг Vademecum показал, что в общей сложности в подобном неопределенном положении пребывает не менее 26 разработок.
Операторы, которым удалось обеспечить свои технологии бессрочными разрешениями Росздравнадзора, продолжают их использовать. В числе таких продуктов SPRS‑терапия от ИСКЧ, занявшая свою нишу в косметологии. «Мы официально запрашивали у Минздрава позицию по трактовке нормы закона, которая говорит, что регистрации подлежат лишь впервые вводимые в практику продукты. И получили ответ: выданные ранее разрешения и применяемые технологии в безусловной перерегистрации не нуждаются», – говорит основатель ИСКЧ Артур Исаев. В 2017 году на этом направлении компания заработала 35,2 млн рублей.
Плати в полоску
Российские клиники и банки, работающие с клеточными технологиями











Работают с клетками, опираясь на аналогичные разрешения, и в НМИЦ онкологии им. Н.Н. Петрова, однако дендритно‑клеточная вакцина, которую здесь применяют, под 180‑ФЗ на самом деле не подпадает. В том же правовом статусе клеточные продукты используются в московской клинике «НейроВита», где, по словам профессора Брюховецкого, занимаются выделением не линий стволовых клеток, описанных в 180‑ФЗ, а их ограниченного количества. Некоторым операторам сегмента пришлось свою деятельность приостановить или свернуть окончательно.
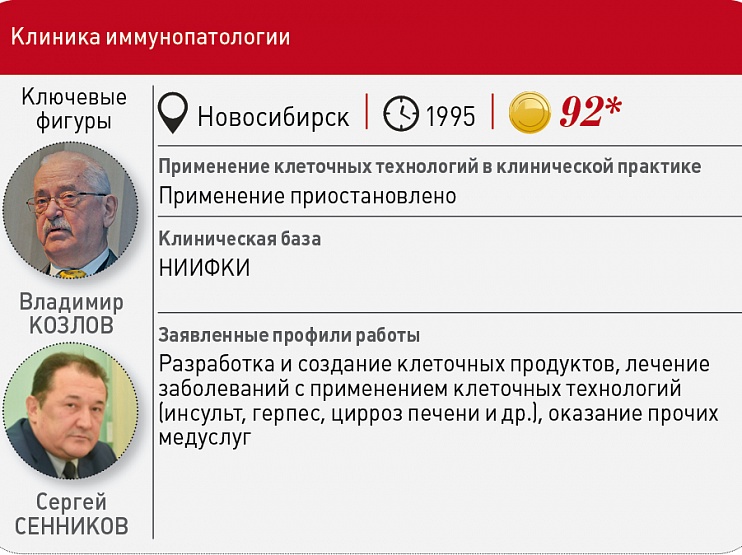
Например, Клиника иммунопатологии НИИФКИ в ожидании полноценной нормативно‑правовой базы клеточные технологии в терапии не использует. Врио директора НИИФКИ Сергей Сенников сообщил Vademecum, что в его медучреждении проводятся только КИ клеточных продуктов, причем на безвозмездной основе: «Конечно, для института это накладно. Но главное – протоколы наших испытаний, к сожалению, пока ложатся в стол, что с каждым днем усугубляет ситуацию – если мы не будем развивать и внедрять в практику разработки, то безнадежно отстанем от других стран. Очень надеюсь, что подзаконные акты в ближайшее время появятся, и мы сможем не только применять наши продукты, но и реализовать наш давний масштабный замысел – создать Центр клеточной иммунотерапии полного цикла. Все наработки по нему уже готовы».
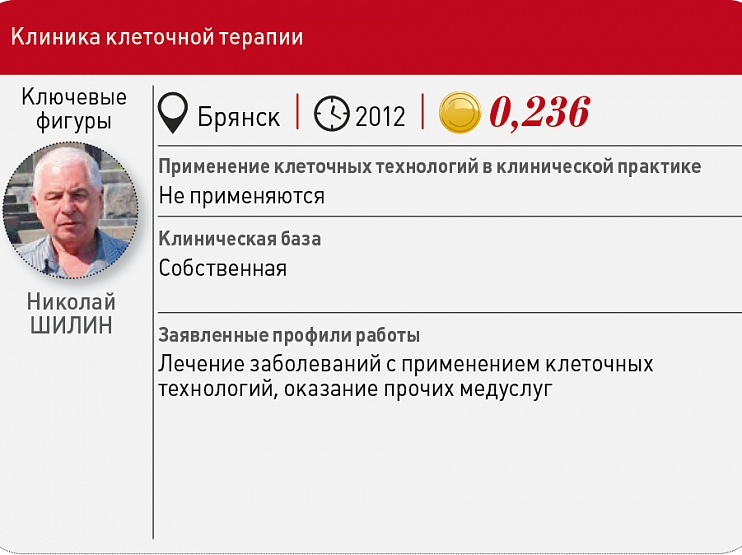
Брянская Клиника клеточной терапии, по признанию ее руководителя Николая Шилина, несмотря на заключенный еще в 2012 году договор с лабораторией МРНЦ им. А.Ф. Цыба о совместной профильной деятельности, выживает за счет оказания самых разных медуслуг, кроме тех, что отражены в ее названии.
Некогда входившая в ГК «Ниармедик» и эксплуатировавшая клеточные технологии московская клиника «Новейшая медицина», как рассказал Vademecum бывший сотрудник медцентра, тоже свою работу приостановила. Дозвониться в клинику не удалось. «Непонятно, почему многолетний опыт медучреждения не может служить основанием для сертификации клеточных продуктов. Наша клиника открылась в 2009 году, и с этого времени мы успешно проводим лечение клеточной терапией, однако новый закон, если в него не внесут необходимых корректировок, подорвет нашу деятельность и работу других подобных медучреждений», – заявляла осенью 2016 года Любовь Вавилова, директор «Новейшей медицины». В мае 2018 года клиника покинула группу «Ниармедик» – владельцем медцентра, по данным СПАРК‑Интерфакс, стал Олег Смирнов, связаться с которым не удалось. В «Ниармедике» на запрос Vademecum о причинах избавления от актива не ответили.
Какие‑то профильные операторы, например, НПО «Инновационные клеточные технологии», занимаются забором и хранением стволовых клеток, а пациентов на лечение отправляют в зарубежные партнерские клиники. Другие игроки рынка решили взять операционную паузу, сохраняя профильные компетенции в качестве банка клеточного материала. Например, медицинский центр при санкт‑петербургском Покровском банке стволовых клеток в клинической практике использует только некультивируемые клетки, не подпадающие под действие 180‑ФЗ.
Тут стоит заметить, что банки пуповинной крови и стволовых клеток успели за последние годы получить довольно широкое распространение. Свой банк есть, например, у ГК «Мать и дитя», которая лечением с помощью клеточных методик не занимается, но готова сохранить материал до 20 лет и доставить в любую выбранную пациентом клинику (транспортировочная услуга оценена в 10 тысяч рублей). В среднем в Москве стоимость забора и заготовки материала стартует от 60 тысяч рублей, а год хранения обойдется в 12–15 тысяч рублей.
В 2016 году востребованные услуги по забору, культивации и хранению стволовых клеток‑фибробластов начал предлагать Институт пластической хирургии и косметологии (ИПХиК), связанный с главным профильным специалистом Минздрава Натальей Мантуровой. В индустрии красоты Мантурова, наряду с пластическими хирургами Александром Тепляшиным и Артуром Рыбакиным, считается убежденным сторонником и проводником клеточных технологий. Накануне издания 180‑ФЗ главный пластический хирург страны устроила тематическую конференцию, с трибуны которой заявила, что закон «в большей степени направлен на развитие тканевой инженерии». Эту тематику, по словам Мантуровой, ИПХиК совместно с Институтом Вишневского и НИИ хирургии детского возраста разрабатывал практически на базе Московской клинической больницы №9. Совместный проект был посвящен лечению пациентов с ожогами, а ИПХиК под эти цели выделил мощности своего криобанка. Впрочем, информация о криобанке сохранилась только в рекламном буклете института. В ИПХиК о нынешней деятельности банка подробно рассказать не смогли, но в колл‑центре института сообщили, что услуги клеточного хранилища для пациентов доступны.
КАПИТАНСКИЕ ЗАТРАТЫ
«И создание производства БМКП затратно, и сам продукт получается дорогостоящим. Это ставит вопрос об экономической целесообразности подобных инвестиций, – рассуждает Дмитрий Голдштейн. – Поэтому российские разработчики делают упор на создание новых методов лечения заболеваний, где клеточные продукты являются практически безальтернативным способом лечения». Так, например, происходит с технологией CAR‑T, подразумевающей забор у пациента Т‑лимфоцитов и их перепрограммирование до состояния появления на них рецептора, способного опознавать опухолевые клетки (химерный антигенный рецептор). Затем модифицированные клетки вновь вводят пациентам. CAR‑T считается эффективной методикой лечения онкобольных, не отвечающих на химиотерапию.
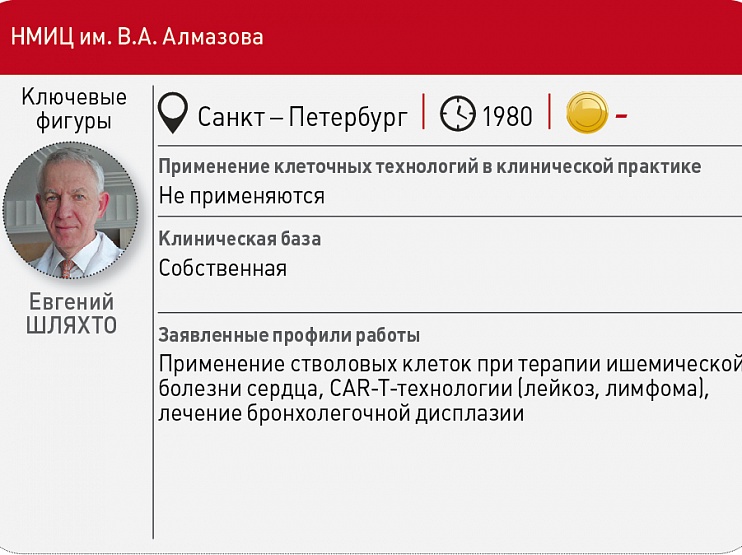
На ПМЭФ‑2018 две крупнейшие российские фармкомпании договорились о сотрудничестве по разработке CAR‑T‑технологий с ведущими научными организациями страны: «Р‑Фарм» вступил в партнерство с Первым МГМУ им. И.М. Сеченова, а «Биокад» – с НМИЦ им. В.А. Алмазова.
Основной тематический проект «Биокада» направлен на разработку CAR‑T‑терапии В‑клеточных лейкозов и лимфом, на более ранних стадиях – на лечение множественной миеломы, рассказал Vademecum вице‑президент компании Роман Иванов. Осваиваемые «Биокадом» БМКП будут предназначены для пациентов, которые не отвечают на стандартную терапию заболеваний и у которых нет эффективных альтернативных вариантов, а ожидаемая продолжительность жизни, как правило, не превышает нескольких месяцев. В Алмазовском центре научились получать CAR‑T‑лимфоциты, специфичные к опухолевому антигену CD19. Этот опыт применяется для получения CAR‑T‑клеток к другим опухолевым антигенам, что может расширить спектр онкозаболеваний, для лечения которых применяется технология, говорят в НМИЦ. Также здесь учатся выявлять и преодолевать механизмы резистентности, разрабатывают аллогенные CAR‑T‑клетки, которые можно будет получать от здоровых лиц, хранить, а затем использовать для терапии больных.
«Р‑Фарм» и Сеченовский университет разрабатывают технологии генодиагностики и генной терапии для персонифицированного лечения ревматоидного артрита, рассказал Vademecum директор университетского Научно‑технологичного парка биомедицины Денис Бутнару. Такие геннотерапевтические препараты смогут применяться, когда стандартная, позволяющая добиться ремиссии, терапия цитостатиками оказывается неэффективной. Ревматоидным артритом в России страдают около 300 тысяч человек, и терапия препаратами на основе моноклональных антител, считает Бутнару, из‑за их высокой стоимости оказывается недоступной для столь многочисленной пациентской аудитории, а кроме того, отличается высоким риском побочных эффектов. И эти обстоятельства делают разработку «Р‑Фарма» и Первого МГМУ весьма перспективной.
В законе о БМКП нет положений, стимулирующих инвестиции в отрасль, отмечает директор Института экспериментальной медицины НМИЦ им. В.А. Алмазова Михаил Галагудза: «Не предусмотрена упрощенная или ускоренная регистрация БМКП для орфанных заболеваний, не прописана и действующая в ряде западных стран упрощенная схема исследования и регистрации минимально модифицированных клеточных продуктов».
Помимо явных законодательных лакун, инвесторов от несомненно перспективного клеточного сектора отпугивает и высокая цена конечного продукта. За рубежом, по словам Дмитрия Гольдштейна, курс лечения некоторыми клеточными препаратами может стоить $60–70 тысяч, и, значит, их тиражирование, а уж тем более лечение с их помощью значительного числа пациентов невозможно без господдержки. Еще выше предполагаемая «Биокадом» стоимость CAR‑T‑терапии – 16 млн рублей (более $250 тысяч) в расчете на одного пациента.
Однако никакой конкретики по поводу финансовой помощи проводникам клеточных инноваций регуляторы пока не озвучили. Денис Бутнару из Сеченовского университета уверен, что отрасль поддержит Минпромторг, а разработка и производство БМКП найдут достойное отражение в стратегии «Фарма‑2030». Об этом ранее заявляли и в самом Минпромторге, но в опубликованном в июле варианте документа ничего о БМКП не сказано.
Финансовая поддержка разработчиков БМКП со стороны Минздрава «возможна только в виде субсидий подведомственным учреждениям на выполнение государственного задания», сообщили Vademecum в министерстве. Закупка CAR‑Т‑препаратов за счет программы госгарантий, говорят в Минздраве, может начаться только после регистрации и апробации, по результатам которой метод может попасть в клинические рекомендации.
Оптимистичнее прочих участников процесса настроены, пожалуй, представители НЦЭСМП, где будет проводиться экспертиза БМКП. «В связи с вступлением в силу 180‑ФЗ и подзаконных актов интерес к разработке и регистрации продуктов на основе клеточных линий человека значительно вырос, – свидетельствует заместитель генерального директора НЦЭСМП Вадим Меркулов. – И в скором будущем мы ожидаем на экспертизу целый ряд БМКП – как аналоги зарубежных препаратов, так и инновационные отечественные разработки».
ИсточникVademecum, №13-14